 ¿ Qué es una "Solución o Disolución" ?.
¿ Qué es una "Solución o Disolución" ?.
Es un sistema homogéneo (una sola fase) formado al mezclar dos o más sustancias , donde una/s de ellas denominada "soluto" se dispersa en la otra denominada "solvente".
Soluto: es el componente de una solución que se encuentra en menor proporción. Pueden ser sólidos, líquidos o gaseosos
Solvente: es el componente de una solución que se encuentra en mayor proporción. Pueden ser sólidos, líquidos o gaseosos.
Formación de una solución:
La Solución siempre adquiere el estado físico del solvente
Ejemplos de disoluciones o soluciones (ambos términos son sinónimos):
Existen sistemas homogéneos (una sola fase) que no son soluciones porque están formados por un solo componente conocido como "sustancias puras" por ejemplo: un tornillo de hierro, un trozo de madera, un vaso de vidrio, étc..
¿De qué depende que dos o más sustancias se puedan mezclar y formar una solución?
Depende de la Solubilidad: que "es la capacidad de una sustancia para disolverse o dispersarse uniformente (por igual) en otra sustancia". Esto ocurre a una temperatura y presión determinada , generalmente se considera 25 grados Celsius y 1 atm (atmósfera)
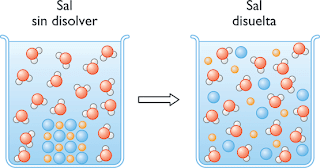 |
| Dispersión de las partículas de la sal (soluto) entre las moléculas de agua (solvente). |
Tenemos una frase en fisicoquímica que dice:
"lo similar disuelve a lo similar", esto se refiere a que las sustancias polares (con cargas) disuelven sustancias polares o iónicas (con cargas), mientras que las no polares (sin cargas) disuelven a las no polares (sin cargas).
Para dejar bien en claro veamos el siguiente
video donde se solubiliza o disuelve el cloruro de sodio más conocida como
la sal de mesa
El agua es considerada el solvente universal, ya que al ser polar (tener moléculas con cargas) puede disolver a la mayoría de las sales, azúcares, ácidos, étc... Por lo tanto una solución puede tener varios solutos disueltos.
Como demostración analizemos los ingredientes de esta solución de bebida gaseosa:
 |
Solvente: agua. Solutos: son 5: 1) dióxido de carbono (gas), 2) azúcar, 3)E-150 d (sulfito de amonio) o sea una sal, 4) E-338 (ácido fosfórico), 5) cafeína.
|
Tipos de Soluciones: pueden ser :diluídas, concentradas y sobresaturadas.
A medida que vamos agregando más cantidad de soluto a una misma cantidad de solvente decimos que la solución va aumentando su concentración.
Por ejemplo: la sal de mesa (sustancia polar) se disuelve en agua (sustancia polar) y su solubilidad es de 35 gramos por cada 100 mililitros de agua. Esto último significa que 100 mililitros de agua (solvente) puede disolver hasta esa cantidad de sal (35 gramos); en caso de seguir agregando esta comienza a formar cristales en el fondo del recipiente observándose dos fases.
- Soluciones no saturadas o diluídas: es cuando el solvente puede continuar aún disolviendo soluto. En el caso de la sal (cloruro de sodio) sería cuando agregamos mucho menos de 35 gramos a 100 mililitros de agua.
- Soluciones saturadas o concentradas: es cuando el solvente a disuelto la cantidad máxima de soluto que puede disolver. En el caso de la sal es cuando se ha agregado los 35 gramos o un valor muy próximo de la misma a los 100 mililitros de agua.
- Soluciones sobresaturadas: es aquella en la que el solvente a disuelto todo el soluto que puede disolver y el exceso de soluto agregado se deposita en el fondo observándose dos fases. En el caso de la salmuera sería cuando agregamos más de 35 gramos de sal a los 100 mililitros de agua.
Observamos los tres tipos de soluciones en el siguiente gráfico:















